楽しく学ぶ…熱力学
ギブスの自由エネルギー(1)化学ポテンシャル
熱力学はジョサイア・ウィラード・ギブスを経て熱機関を離れ, 森羅万象すべてを記述する熱力学へと発展した。
\(\boldsymbol{U-TS+PV}\)の発見 定義ではない。導出でもない。発見である。
ギブスは\(~U(S,V)~\)平衡曲面の研究から, 三相平衡状態では\(~\boldsymbol{U-TS+PV}~\)なる量が一定となることを見出した(1873年4月論文)。後年
ギブスの自由エネルギーと名付けられたこの物理量について理論的背景を与えたのが, 1876~1878年に発表した化学熱力学の金字塔『不均一な物質系の平衡に就いて』である。
ギブスが「ポテンシャル」と呼んだ物理量は, やがて「化学ポテンシャル」と名称を変え, 物質の相平衡, 化学平衡において最も重要な物理量となった。
ギブスの考えたこと
体積一定の容器に水を少し入れる。やがて水の一部は蒸発し, 容器内は一定の温度, 圧力で安定する。
二相平衡である。系の内部では変化が起きているのに\(~T,\;p~\)は一定で, 温度を変えることなく熱がやり取りされ, 圧力を変えることなく仕事がやり取りされている。理想気体ならば何も起こらない等温・定圧だが何かが起きている。しかし\(~dU=TdS-pdV~\)からは変化は読み取れない。
変化の過程では水と水蒸気の質量の割合は変化するだろう。そしてその質量変化に応じた何かが存在し, 全体として\(~dU=TdS-pdV~\)が成り立っている。そしてその何かは質量変化には依存しない量, つまり示強性の量であろう。
\(U(S,V)~\)平衡曲面の考察から, 特別な物理量\(~\boldsymbol{U-TS+PV}~\)を見出したギブスは, 3年後の論文に於いて理論的な背景を与えた。
各相(水と水蒸気)の質量は明らかに変化しているので, 物質の質量\(~m~\)を内部エネルギー\(~U~\)の新しい変数とし,
\[U=U(S,V,m)\tag{1} \]
とすべきである。\(\rm He\)1モル\(~22.4\ l~\)と\(~\rm He\)2モル\(~44.8\ l~\)は同じと言えば同じであり, 物質量は新しい自由度とは言えない。理想気体の自由な状態変数は2の所以である。しかし相平衡に於いては, 物質量は新しい自由度となっている。(1)式の微小変化を取ると
\[\begin{align}
dU&=\dd{U}{S}dS+\dd{U}{V}dV+\dd{U}{m}dm \\
&=TdS-pdV+\mu dm\tag{2}
\end{align} \]
または
\[dS=\frac{1}{T}(dU+pdV-\mu dm)\tag{3} \]
である。この
\[\mu=\left(\dd{U}{m}\right)_{S,V}\tag{4} \]
をギブスは「ポテンシャル」と呼んだ。いわゆる化学ポテンシャルである。そして2相の夫々の化学ポテンシャルが等しい
\[\left(\dd{U}{m_I}\right)_{S,V}=\left(\dd{U}{m_{II}}\right)_{S,V}\tag{5} \]
これが相平衡の条件であり, この化学ポテンシャルに物質量を乗じたものの総和が\(~G~\), すなわち
\[\begin{align}
G\equiv U-TS+pV&=\left(\dd{U}{m_I}\right)_{S,V}dm_I+\left(\dd{U}m_{II}\right)_{S,V}dm_{II}\\
&=\mu_Idm_I+\mu_{II}dm_{II}\tag{6}
\end{align} \]
であり,三相平衡ではこの値が一定に保たれるというのが, 平衡曲面の研究から得たギブスの結論である。
これだけでは何のことだか分からないので, ギブスの思考実験を通じて, もう少し詳しく考察しよう。
なをこの「ポテンシャル」という名称であるが, 力学あるいは電磁気学のポテンシャルに似ている程度の意味である。クーロンポテンシャルは質量分布のない場所ではラプラスの方程式をみたす。ラプラスの方程式をみたす関数を調和関数と呼ぶ。この調和関数に関連した数学の分野をポテンシャル論と呼ぶが, そこまで厳密な意味では無い。最後にもう一度触れる。
ギブスの思考実験
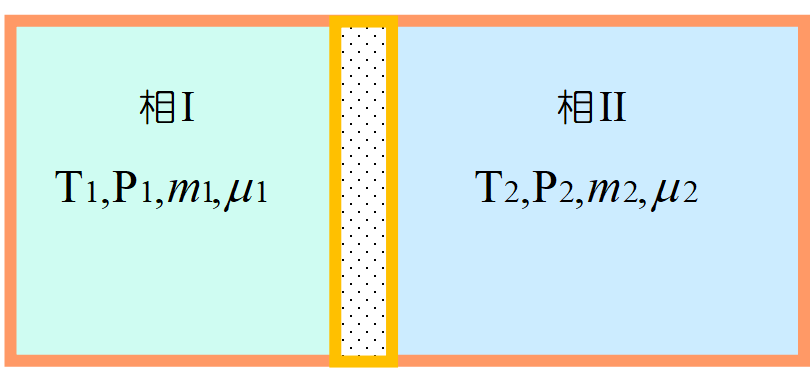
閉じた2つの相が隔壁で分けられている。この隔壁を操作して最終的に2つの相を混合する場合を考える。
詳しくは山本義隆著「熱学思想の史的展開3 熱とエントロピー」\(p258\sim 259~\)参照。
断熱容器を断熱壁で隔てた2つの相は完全に分けられており, それぞれの相で平衡が成り立っている。このような状態を「束縛平衡」と呼ぶ。
各相の質量\(~m_i~\)は束縛を緩めれば変化し得るから変数である。相\(~\rm I~\)の内部エネルギーを\(~U_1(S_1,V_1,m_1)~\)とすれば,
\[dU_1=T_1dS_1-p_1dV_1+\mu_1dm_1 \]
または
\[dS_1=\frac{1}{T_1}(dU_1+p_1dV_1-\mu_1dm_1) \]
である。系全体では\(~U=U_1+U_2\), \(S=S_1+S_2\), \(V=V_1+V_2\), \(M=m_1+m_2~\)である。また\(~\mu_1~\)は
\[\mu_1=\left(\dd{U_1}{m_1}\right)_{S_1,V_1}\tag{7} \]
である。\(\mu_1~\)を相\(~\rm I~\)の「化学ポテンシャル」と呼ぶのは前述した通りである。この「化学ポテンシャル」の具体的なイメージはもう少し後で説明する。
ギブスの議論を続けよう。系全体は閉じているから,
\[\begin{align}
& dU=dU_1+dU_2=0 \\
& dV=dV_1+dV_2=0 \\
& dM=dm_1+dm_2=0
\end{align} \]
である。従って自発変化に対して,
\[\begin{align}
dS&=dS_1+dS_2 \\
&=\left(\frac{1}{T_1}-\frac{1}{T_2}\right)dU_1+\left(\frac{p_1}{T_1}-\frac{p_2}{T_2}\right)dV_1-\left(\frac{\mu_1}{T_1}-\frac{\mu_2}{T_2}\right)dm_1 \ge 0
\end{align} \]
これが, クラウジウスのエントロピー理論に物質量の変化を加えた, 束縛平衡状態での各熱力学変数の取るべき状態である。
右辺が\(~1/T_1+1/T_2~\)ではなく, \(1/T_1-1/T_2~\)となっているのは, エントロピーは通常正の値として扱うからである。熱の移動に際して, 一方のエントロピーが増加すればもう一方は減少する。負のエントロピーが増加すると聞いたことは無い。
透熱性隔壁 熱だけ移動する。
ここで隔壁を透熱性にする。\(dV_1=dV_2=0,\;dm_1=dm_2=0~\)だから自発変化ではエントロピー増大により,
\[dS=\left(\frac{1}{T_1}-\frac{1}{T_2}\right)dU_1\ge 0 \]
である。もしこの時\(~T_1\lt T_2~\)ならば\(~dU_1 \gt 0,\;dU_2\lt 0\;(\gets dU_1+dU_2=0)~\)となるので, エネルギー(熱)は高温から低温へ移動する。
また平衡では\(~dS=0~\)より, \(T_1=T_2=T~\)となり, 温度平衡, つまり熱的平衡を表す。新しい事実は無い。既存事実の確認である。
隔壁移動 各相の体積が変化する。
次に隔壁を移動できるようにする。上記と同様にして,
\[dS=\frac{1}{T}(p_1-p_2)dV_1\ge 0 \]
である。\(p_1\gt p_2~\)ならば\(~dV_1\gt 0,\;dV_2\lt 0~\)となるので, 隔壁は圧力の高い方から低い方へ動く。平衡では\(~p_1=p_2=p~\)で, 圧力平衡, つまり力学的平衡を表す。
これも既存事実の確認である。
隔壁除去 2相の化学ポテンシャルが一致する。
今度は隔壁そのものを取り除く。既に温度・圧力は等しくなっているが, 2相が混じるので, 取り除いた瞬間は平衡では無い。自発変化は
\[dS=-\frac{1}{T}(\mu_1-\mu_2)dm_1\ge 0 \]
の向きに進む。
\(\mu_1\lt \mu_2~\)ならば\(~dm_1\gt 0~\)。すると\(~dm_2\lt 0~\)。\(\mu_i~\)の小さな相(化学種と言ってもよい.)の物質量が増加し, \(\mu_i~\)の大きな相の物質量が減少する。
すなわち「全体として, ポテンシャルの減少する」向きである。例えば水と水蒸気が共存しているとき, \(\mu_{water}\gt \mu_{vapour}~\)ならば, \(dm_{water}~\)が減少し, \(dm_{vapour}~\)が増加し気化が進む。平衡では\(~~dS=0~\)より\(~\mu_1=\mu_2~\)である。
これがギブスの発見した新しい事実である。\(p_1=p_2~\)が力学的平衡を, \(T_1=T_2~\)が熱的平衡を, \(\mu_1=\mu_2~\)が相平衡を与える。
結局化学ポテンシャルとは何か?
\(\mu_1=\mu_2~\)とか言っているがイメージをつかみにくい。ここで\(~\mu_1,\;\mu_2~\)を具体的に考えて見よう。
質量の単位を1モルとする。すると(7)式, \(\displaystyle \mu_1=\left(\dd{U_1}{m_1}\right)_{S_1,V_1}~\)は相\(~\rm I~\)の物質が1モル変化したとき, 相\(~\rm I~\)の内部エネルギーが\(~\mu_1\)づつ変化するということである。
相\(~\rm I~\)を水蒸気, 相\(~\rm II~\)を水とすれば, 水が1モル減って(\(~dm_2=-1\)), 水蒸気が1モル増えた(\(~dm_1=+1\))時, 相\(~\rm I~\)の内部エネルギーの増加と言えば, それはいわゆる「気化熱」だろう。
今度は水蒸気が1モル減って, 水が1モル増えた時, 増加する水のエネルギーは「凝縮熱」だろう。水蒸気と水が極めてゆっくり変化してお互いを行き来する平衡では「気化熱と凝縮熱は等しい」これが(5)式, \(\displaystyle \left(\dd{U}{m_I}\right)_{S,V}=\left(\dd{U}{m_{II}}\right)_{S,V}~\)の意味するところである。
と思うのだが, こんなに馴染み深い量での説明を殆ど見かけない(難しい説明は多いが.)。不安にもなるが, 全く間違っているわけでもないだろうから, \(\mu_1=\)1モル当たりの気化熱, \(\mu_2=\)1モル当たりの凝縮熱で行こう。相平衡条件\(~\mu_1=\mu_2~\)とは気化熱\(~=~\)凝縮熱である。
質量の単位をモル数でなく, 粒子数とすることも出来る。統計力学では分子数を単位とする。
固体電子論における電子系(例:電子ガス)でも化学ポテンシャルを定義することが出来, 特に温度\(~\rm T=0^{\circ}K~\)における化学ポテンシャル\(~\mu~\)を, フェルミエネルギー\(~E_F\equiv \mu(\rm T=0^{\circ}K)~\)と呼ぶ。
ギブスの自由エネルギー 現代風の説明も必要だ。
上記ではギブスの思考を辿ってギブスの自由エネルギー, 化学ポテンシャルを考えた。しかし1876~1878年の300ページに及ぶ大論文は極めて完成度が高く, 途中の七転八倒の思考過程はすっかり取り除かれている。
山本氏が丁寧に説明してくれているが, それでも我々凡人には敷居が高い。取敢えず納得するのも必要であろう。先人の労苦は偲べないが, 教授法に優れた現代風の解説も挙げておこう。
ヘルムホルツの自由エネルギー\(~F~\)は,
内部エネルギーを自由に使える部分と, そうでない部分とに分けた。
このことが熱力学を化学反応に適用するのに大いに役立った。\(~F~\)の微小量は\(~d(U-TS)~\)より
\[\begin{align}
dF&=dU-TdS-SdT \\
&=SdT-pdV-TdS-SdT \\
&=-SdT-pdV\tag{16}
\end{align} \]
である。自然な変数は\(~T~\)と\(~V~\)だが, 自然界の多くの変化は大気圧, 室温で為される。変数を\(~T~\)と\(~p~\)に変えよう。
\[d(pV)=pdV+Vdp\]
を(16)式に加えると
\[d(F+pV)=-SdT+Vdp\]
となり, 自然な変数が\(~T~\)と\(~p~\)になった。
\[F+pV=U-TS+pV\equiv G\]
をギブスの自由エネルギーと定義する。
次に熱平衡条件\(~d'Q-TdS\ge 0~\)を\(~G~\)で表そう。\(d'Q=dU-TdS+pdV~\)及び, 等温, 定圧条件\(~dT=0,\;dp=0~\)を使って
\[d(U-TS+pV)=dU-TdS+pdV-SdT-Vdp=d'Q-TdS\ge 0\]
を得る。随分とスマートに求まる。結局
\[dG\ge 0\tag{17} \]
が等温, 定圧における熱平衡条件で, その状態のギブス自由エネルギーが極小となっていることである。あるいは等温, 定圧下ではギブスの自由エネルギーが減少する方向が自発変化の進む方向である, と言える。
化学ポテンシャル名前の由来追加。
重力エネルギーは示強変数としての重力ポテンシャル\(~gh~\)に示量変数としての質量\(~m~\)をかけた\(~mgh~\)であり, 静電エネルギーは示強変数としての静電ポテンシャル(電位)\(~\phi~\)に示量変数としての電荷\(~q~\)をかけた\(~q\phi~\)である。化学反応の際の物質の持つエネルギーが示強変数としての\(~\mu~\)に示量変数としての質量\(~m~\)をかけた\(~\mu m~\)になっている。これが\(\mu~\)を化学ポテンシャルと呼ぶ理由である。(原文では内包量, 外包量という単語が使われているが, 馴染みが薄いので熱力学の用語を用いた.)