楽しく学ぶ…熱力学
温度・熱・熱平衡
熱力学の基本概念。分かったような分からないような。
熱力学は, 分子や原子が認められていなかった時代に建設された。ニュートン力学は量子力学や相対性理論によって大幅な修正を余儀なくされたが, 熱力学は電磁気学と並んで全く修正を受けなかった。そればかりでなく宇宙の創生に関して, 量子論, 相対性理論に劣らず輝き続けている。
大学で熱力学・統計力学の授業を受けていた時, 故市村浩教授が「熱力学は不思議でねぇ。曖昧な量(温度, 熱と思われる。記憶は定かではない.)を積み上げて学問をなしている。これが正確に様々な世界に当てはまる。不思議だねぇ。」講義の内容は忘れたが, この言葉だけは憶えている。
熱力学の普遍性 熱力学は不要か?
統計力学が確立している現在, 熱力学は最早不要であるという意見も聞く。本当に不要なのか?
熱力学は五感で分かるマクロな事象から, 人間の創造力を駆使して生まれた理論体系である。最近の研究では, 原子数が数十個のミクロなスケールから, 我々の日常のスケール, 宇宙や星の内部というような巨大なスケールにまで熱力学の諸法則が成立していることが明らかになりつつある。
黒体輻射のシュテファン・ボルツマンの法則は, 限界はあるが熱力学によって容易に導かれた。導出は統計力学でも困難であり, この困難さが量子力学誕生のきっかけとなった。
超弦理論ではカラビ・ヤウ多様体の10次元の世界が論ぜられている。当然五感を超えた世界である。10次元に挑む姿も素晴らしいが, 五感と人間の創造力は想像以上の威力を秘めていそうである。(ここら辺のことは熱力学の教科書には書かれていないので, 筆者の独善です)。
熱平衡状態・準静的過程・可逆過程
系・環境・外界 熱力学的な世界と力学的な世界
“系”とは物質の集まりのこと。この記事では最も単純な系, 理想気体を考える。
状態量が決まり, 測定される“系”として, 圧力が任意に変化できるピストンを持ち, また外界と接し, 任意の温度の熱源と自由に接続・断絶できる側壁を持つシリンダーに詰めた“\(~n~\)モルの均質な気体”とする。
ただし, 熱力学は, 液体, 固体, 相転移のみならず宇宙の構造まで適用できる「普遍性(いつでもどこでも何にでも当てはまる)」を備えていることを忘れてはならない。
系と熱や仕事をやり取りする外界は、そのやり取りが準静的(可逆的)に行えるように, 圧力や温度が連続的に変化する“無限個の仕事浴”や“無限個の熱源”からできていると仮定する。
実はこう定義すると不都合なこともある。ヘルムホルツの自由エネルギーを考える時は, 系=ピストン付シリンダー+熱源, 外界=さらにその外と考えた方が分かり易い。
熱平衡状態 熱素説ではこうなる。
熱力学的平衡とは, 巨視的(熱力学的)状態量が一定の値を保持し, 変化しない状態のことである。熱素説で説明をしてみよう。
物を燃やした時に, 質量ゼロの微小な粒子, 熱素が放出される。熱素は酸素と同じく, 空中を漂っていける気体の元素で, 生成も消滅もしない。
この熱素粒子は互いに反発し合い, あらゆる物体の中に存在するとされる微小な孔(アナ)に染み込み, 中に拡散していってその物体を温める。
高温の物質ほど沢山の熱素が染み込んでいる。反発し合う性質のために, 熱は高温の物体から低温の物体に広がり, やがて温度の差が無くなる。
この温度差が無くなった状態を「熱平衡状態」と呼び, 「\(~\rm A~\)と\(~\rm B~\)は熱平衡にある」と言う。これでも十分良さそうであるが!
現代の我々は一笑に付すが, カルノーはこのような時代背景のもとで考えを進めなければならなかった。
準静的過程と可逆過程 必ずしも同じではない!
準静的過程とは, 操作の途中でも系が常に熱平衡状態にあるように, 操作をゆっくり行う過程である。
準静的過程は必然的に可逆過程となるが, 逆は必ずしも正しくない。
ピストンを断熱的に急激に圧縮しても, その力を取り除けば気体は反発して直ちに元の状態にもどる。すなわち可逆過程である。断熱膨張でも, シリンダー内の気体の膨張が間に合わないほど早くピストンを動かす場合を除き(この場合は標準より少ない仕事しか出来ない), ほどほどの荒っぽさでは可逆過程である。
温度・熱 3つの温度の定義。
熱力学において, 温度という物理量は決定的に重要な役割を果たす。その温度はどう定義するのか?
定義(1) 経験的温度 こんな定義で良いのか?
温度計の指す目盛りを温度\(~\rm T~\)とする。こんな定義で良いのか?良いのである。
\(\rm A~\)という物質と水銀温度計を長時間接触させると温度計はある目盛りを指す。同様の事を\(~\rm B~\)という物質に対して行った時, 温度計が同じ目盛りを指せば, \(\rm A~\)と\(~\rm B~\)は同じ温度である。「熱力学第ゼロ法則」と呼ぶこともある。温度計の目盛りが変化しなくなった状態を熱平衡と呼ぶ。
水銀温度計を水の三重点に十分長く置いたとき指す点を\(~273.16°\rm K~\), 9.1気圧のもとでの水の沸点に十分長く置いたとき指す点を\(~373.15°\rm K~\)と目盛り, その間を99等分した1目盛りを\(~1°\rm K~\)または\(~1°\rm C~\)とする。但し水銀の膨張は厳密には温度に対して直線的ではないため, その補正はする。
全ての物質において, 温度と体積は決まった関係にあり, 体積を測定することによって温度を推測できる。
推測と言ったのは, 温度が気体や固体の膨張を引き起こすメカニズムは解っておらず, またその膨張による温度は, その値を知っても, 温度の実体については何も教えてくれないからである。
現在, 経験的温度は2種類ある。Fahrenheit。中国語で華倫海特, 華倫海特氏が作ったと言う意味で華氏~度と言う。Celsius。中国語で摂爾修斯, 摂氏~度と言う。
定義(2) 理想気体温度
水銀では心もとないので, 理想的な気体を想定して, その体積の膨張係数から温度を推測する。
\[T=\frac{pV}{nR}\]
で定義する。記号は理想気体の状態方程式から明らかだろう。
水銀を理想気体としただけで, 本質は何も変わっていない。ただし温度を下げると, やがて体積が0(ゼロ)になる絶対温度を示唆している。
単位は絶対温度\(~°\rm K~\)である。水素ガスの膨張率を利用した, 水素温度計と言うものがあるそうである。
ここで注意すべきは, 理想気体そのものが仮想的なものであり, その膨張係数で定める絶対温度Tも同じく仮想的なものである。従って「絶対温度を定義して, その温度に従う気体を理想気体とする」というような論法は循環論法であり, 定義にはなっていない。
定義(3) 熱力学的温度 ケルビン卿の名を残す\(~^\circ \rm K~\)
熱力学の先駆者サディ・カルノーは, 理想的な熱機関, カルノーサイクルで思考実験を繰り返し, その効率を追求した。
そして,
カルノーの原理
(1) 熱機関の最大効率は, 作業物質にはよらず, 2つの温度のみで決定される。
(2) どの可逆熱機関も効率は同じで, 最大である。
を発表した。カルノーの可逆サイクルの真の意味を研究していたトムソン(ケルビン卿)は, エネルギー保存則だけに基づいて, 今日言うところの絶対温度を導けることに気が付いた。1848年のことである。
概ね次のような(実際は相当難解で複雑な)推論を重ねた。熱機関の効率は,
\[\eta=\frac{Q_H-Q_L}{Q_H}=1-\frac{Q_L}{Q_H}\tag{1} \]
であり, これが温度のみによるのであるから, \(Q_L/Q_H~\)は温度の関数で,
\[\frac{Q_L}{Q_H}=f(T_H,T_L)\]
である。(1)式はトムソン(ケルビン卿)による表現である。カルノーは\(~\eta=W/Q_H~\)と表し, エネルギー保存則に一歩及ばなかった。
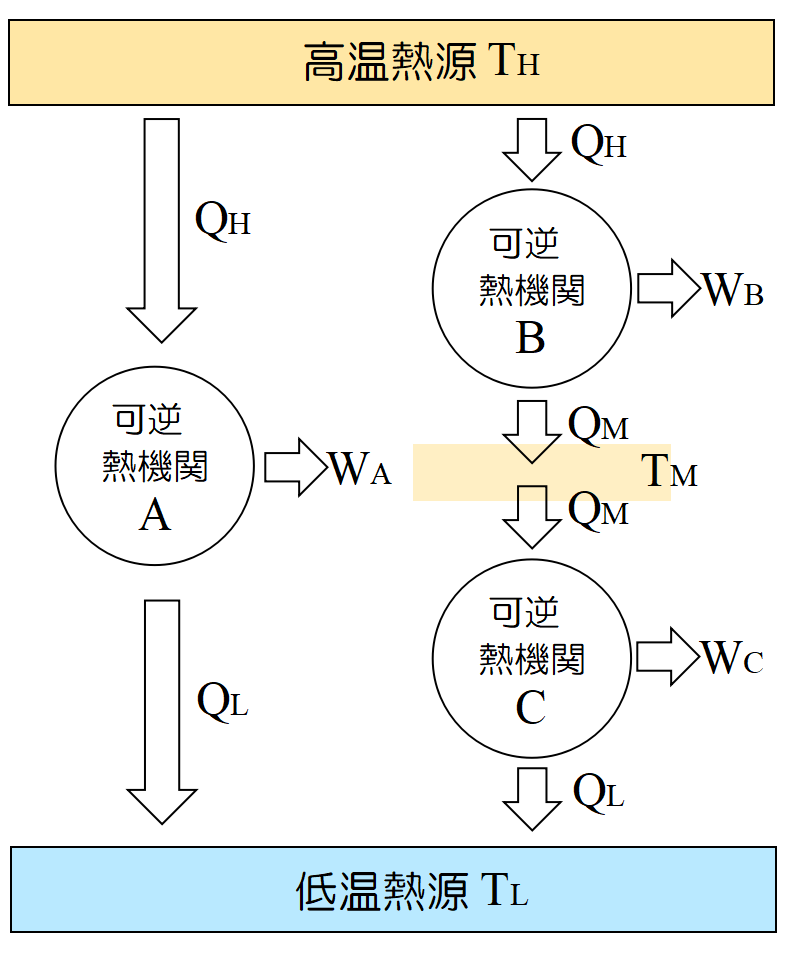
ここで可逆熱機関を2つ直列に並べてみる。
同様の式を当てはめると,
\[\frac{Q_L}{Q_H}=f(T_H,T_L),\;\frac{Q_M}{Q_H}=f(T_H,T_M),\;\frac{Q_L}{Q_M}=f(T_M,T_L),\;\]
である。\(\displaystyle \frac{Q_L}{Q_H}=\frac{Q_M}{Q_H}\x \frac{Q_L}{Q_M}~\)だから,
\(f(T_H,T_L)=f(T_H,T_M)\x f(T_M,T_L)~\)である。これが成り立つためには,
\[f(T_H,T_L)=\frac{\phi(T_L)}{\phi(T_H)} \]
でなければならない。しかし, \(\phi~\)の形は熱力学からは決められない。
そこで天才トムソン(ケルビン卿)は, 考えに考えを重ね, 飛躍はあるが,
\[\phi(T)\equiv T \]
と置いて, これが絶対温度\(~\rm T~\)を定める式だと考えた。そして,
\[\frac{Q_L}{Q_H}=\frac{T_L}{T_H}\tag{2} \]
という関係を導いた。\(T_H~\), \(T_L~\)は夫々高温熱源, 低温熱源の温度, \(Q_H~\), \(Q_L~\)は夫々の熱源とやり取りする熱量である。
この温度を熱力学的温度と呼ぶ。気体の膨張率(およそ\(~1/273~\))からではなく, カルノー機関の効率, すなわち「熱力学第二法則」から求めたのが特徴である。
そして, この絶対温度に
積分因子という素晴らしい特質が具わっていることに最初に気づいたのはクラウジウスである。
熱機関の効率\(~\eta~\)は, 投入された熱量\(~Q_H~\)に対する仕事\(~W=Q_H-Q_L~\)の割合だから
\[\eta=\frac{Q_H-Q_L}{Q_H}=1-\frac{T_L}{T_H} \]
低温熱源の温度をどんどん下げてゆくと, やがて効率が1になる。この温度を絶対0度とする。思考実験から得られた温度である。効率が1を超えるとはエネルギー保存則を破ることである。よってこの絶対0度が存在しうる最も低い温度である。
理想的な熱機関のシリンダー内の気体が\(~-273°\rm C~\)(絶対零度)であれば, 効率は1。すると労力を全く必要とせずにピストンを最初の位置に押し戻すことができる。つまり, その気体は一切圧力を及ぼさないことになる。
絶対零度の物質の挙動は, 量子力学によって明らかにされた。熱力学はそれより70年以上も前に, 絶対0度の気体の性質を教えていたのである。
1954年パリ近郊のセーブルで開かれた国際度量衡会議で, 絶対温度スケールに「ケルビン」の名前が与えられた。
ところで(2)式は
\[\frac{Q_H}{T_H}-\frac{Q_L}{T_L}=0 \]
とも書ける。クラウジウスは, ここからエントロピーの概念を確立してゆく。
熱 定義は最も難しい。「熱は熱」でも結構間に合う。
温度に次いで分からないのが
熱だろう。実は熱力学は熱を用いないで定式化できるのである。マクロな事実のみから構成される熱力学の不思議であるが, 頑張って定義して見よう。
熱力学第一法則
\[dU=d'Q+d'W\]
において, 力学的仕事\(~d'W~\)を除くすべてのエネルギーを「熱」とする。
もっと俗っぽい言い方をすると, (力学的な)目に見えるエネルギーが「仕事」で, 目に見えないエネルギーが「熱」である。
注意すべきは, 直接目に見えなくとも, 外界のマクロな状況の変化から確定できるエネルギーの移動は全て「仕事」とみなす, ことである。
例えば流体中の羽根車を回すことによる温度上昇や, 電熱線によるジュール熱の発生は, 「熱ではなく力学的な仕事」とみなされる。羽根車に付けた重りの落下距離や, 発電機を回す水車の水の落差からエネルギーを確定できるからである。然しここで, またもや注意が必要である。
これらの「仕事」はピストンの移動, より一般的には「示量変数」の変化による仕事とは異なっている。
ピストンによる仕事は「仕事\(~\rightleftarrows~\)熱」の相互変換が可能である。ジュール熱や羽根車の回転の場合は「仕事\(~\to~\)熱」の一方的な変換のみである。(←田崎晴明 熱力学)
カルノー, トムソンも悩んだ所で「熱も仕事に変えられる」ことを大胆に進めたのはクラウジウスである。
多くの読者は高校で
分子運動論を習っているだろう。その立場からは「何を小難しいことを言うのか?容器の壁の分子振動が気体の分子を振動させ温度を上げる」となる。
しかし, 分子運動論からエントロピーは導かれない。エントロピーは, 物理現象に確率の概念を初めて持ち込んだマックスウェル, およびそれを引き継いだ「ボルツマンの統計」が必要となる。トムソン(ケルビン), クラウジウス等の熱力学者は, 温度, 熱からすべてを導いた。